eLife lncRNA HOTAIR小鼠模型解析其促进乳腺癌细胞转移的机制
发布时间:2023-02-10北京时间12月29日,中科院深圳先进院马晴研究员课题组与斯坦福大学Howard Chang实验室、上海交通大学李令杰课题组合作,在国际学术期刊eLife上发表了题为“Inducible lncRNA transgenic mice reveal continual role of HOTAIR in promoting breast cancer metastasis”的研究论文。
该研究首次建立了可诱导过表达人类长非编码RNA HOTAIR的小鼠模型。通过该小鼠模型,该研究展示了HOTAIR过表达能影响肿瘤细胞的染色质开放性程度,从而调控基因表达,并最终促使小鼠乳腺肿瘤向肺部转移。更重要的是,通过撤除诱导剂来取消HOTAIR的过表达水平后,细胞的染色质开放性和基因表达改变都能有所回复,且细胞转移能力也会降至原来的水平,这说明该促使乳腺癌细胞转移的过程需要HOTAIR的持续表达来维持,这意味着HOTAIR可以作为抑制乳腺肿瘤转移的潜在治疗靶点。

文章上线截图
长非编码RNA(long non-coding RNA, 简称lncRNA)是一类长度大于200个核苷酸的非编码RNA,在哺乳动物中大量表达,是基因调控网络中的重要调控因子。目前已发现多种长非编码RNA在肿瘤的发生、发展和转移过程中起到重要作用。
HOTAIR(HOX antisense intergenic RNA)就是一种长度为2.2 kb的长非编码RNA,在乳腺癌等多种癌症中都有过表达,是肿瘤细胞发生转移和扩散及造成死亡的预测因子,那么HOTAIR是否适合作为癌症的治疗靶点呢?目前诸多研究显示HOTAIR能够调控细胞的表观遗传状态,但是调控机制尚未完全清楚。在表观遗传调控中,存在一种“表观遗传记忆”机制,即一些表观遗传调控因子能诱导细胞基因表达谱长期稳定的改变,即使这些表观遗传调控因子不再持续表达。那么HOTAIR诱导的表观遗传状态的变化是否存在长期的“表观遗传记忆”,这也关系到HOTAIR是否能成为抑制乳腺癌转移的治疗靶点。
为了解决上述问题,本研究构建了诱导型过表达人类HOTAIR基因的小鼠模型,并将其与能自发产生乳腺肿瘤的小鼠杂交,最终得到了既能诱导过表达人类HOTAIR又能自发产生乳腺肿瘤的小鼠模型。通过该小鼠模型,该研究展示了人类HOTAIR在小鼠中过表达不影响小鼠乳腺肿瘤的增殖,但能促使乳腺肿瘤向肺部转移(图1)。说明了虽然人类HOTAIR基因和小鼠同源基因在序列上很不一致,但是在功能上仍具有高度的保守性,且该小鼠模型可用于研究人类HOTAIR基因在体内的功能机制。
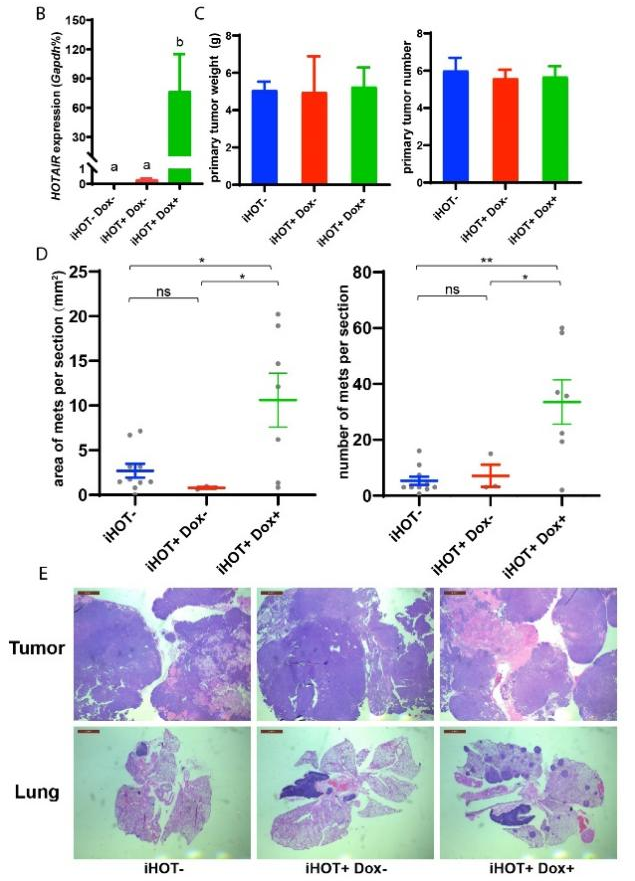
图1. 诱导过表达HOTAIR促使小鼠乳腺肿瘤向肺转移,但不影响原始肿瘤的重量和数量。
接下来,本研究从该小鼠的肿瘤组织中分离出乳腺癌细胞,称为iHOT细胞,该细胞在加入诱导剂Dox后能过表达HOTAIR,而撤掉诱导剂后,HOTAIR表达量很快降回原本水平,由此得到了一种可以控制HOTAIR表达量的乳腺癌细胞。通过表型实验发现,该细胞在诱导过表达HOTAIR后转移能力增强,而HOTAIR表达降低后,转移能力也随之减弱(图2)。
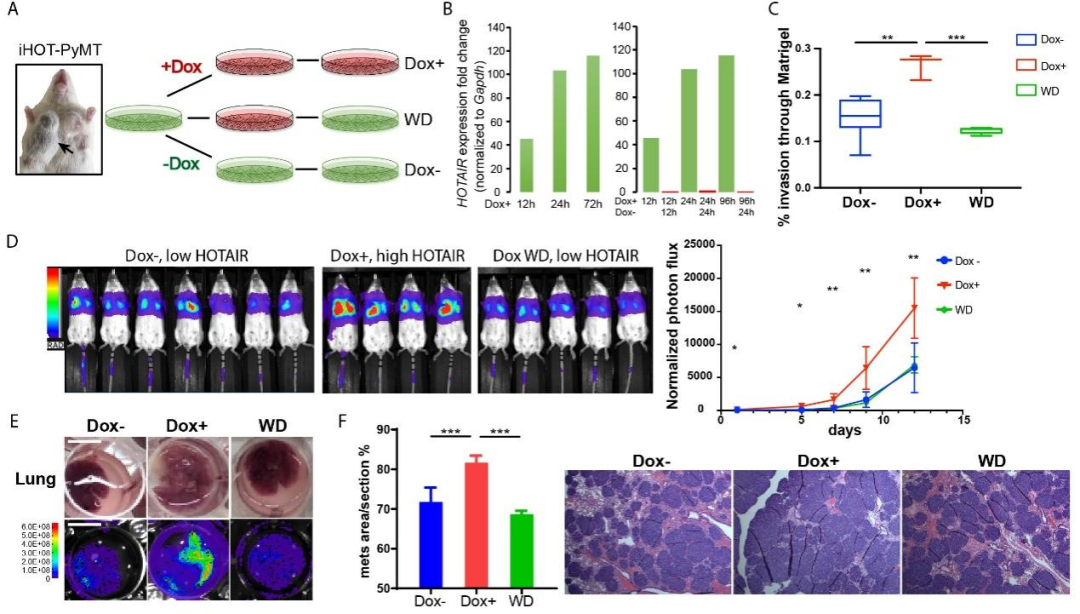
图2. iHOT乳腺癌细胞的转移能力随着HOTAIR表达量变化而变化。
该研究进一步分析了基因表达和染色质开放性情况,发现HOTAIR过表达能调控大量细胞转移相关基因的染色质开放性和表达变化;而撤掉HOTAIR以后,这些染色质开放性和基因表达改变都能回复到初始状态(图3)。这说明HOTAIR诱导的表观遗传状态的改变不具有长期的“表观遗传记忆”效应。这些结果也说明了HOTAIR可以作为一个潜在的抑制肿瘤转移的直接治疗靶点。
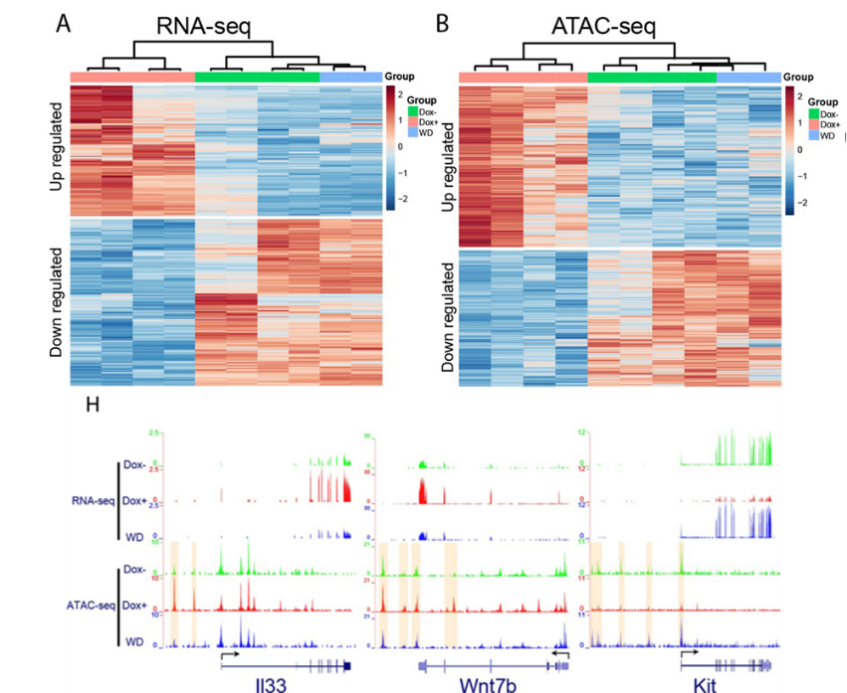
图3. HOTAIR诱导的基因表达和染色质开放性变化也随着HOTAIR降低而恢复。
中科院深圳先进院合成所马晴研究员、斯坦福大学Howard Y. Chang教授和上海交通大学李令杰教授为本文共同通讯作者,马晴研究员、其课题组助理研究员杨柳依和斯坦福大学Karen Tolentino为共同一作。该研究得到了国家重点研发计划、国家自然科学基金、广东省基础与应用基础研究基金、广东省合成基因组学重点实验室、深圳市合成基因组学重点实验室、中国科学院战略性先导B培育项目、深圳合成生物学创新研究院等多个项目的支持。


