这枚诺奖背后,是一位坚持己见的女助手
发布时间:2022-10-11作为一名刚迈入实验室的科研新人,你可能对做科研踌躇满志,心想:“我只要先做这几个实验,得到初步结果,然后再进一步挖一下背后的机制,最后再进行这些完善,你看,搞科研也不难嘛。”
然而,摸爬滚打一段时间后,面对千奇百怪的实验结果,你的心态会经历从沮丧到麻木再到见怪不怪这样一个过程。其实,实验结果与预期不一致可太稀松平常了。
在这里借用系统生物学家Uri Alon画的一张图:生命科学研究中只有少部分是按既定的目标实现的(A→B),实际研究中,大部分可能都是按照非预期的路线进行的(A→C)。
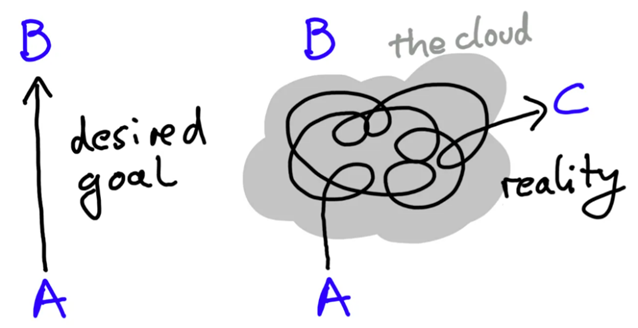
今天的这篇文章,我们本来也是要讲一名科学家从意外的实验结果中做出惊人发现的故事。为什么要说“本来”呢,在这里先卖个关子,以下是这篇文章最初稿件的部分内容,时间充裕的情况下建议观看一下。
STORY
1954年,赛韦罗·奥乔亚(Severo Ochoa )正在纽约大学医学院生物化学系担任教研主任,彼时的他已经在脂肪酸代谢、二氧化碳固定等多个领域取得了建树。此时,他开始全身心投入核酸生物合成机制的研究中。

西班牙马德里康普鲁腾塞大学
奥乔亚雕像
一天,他让女助手纯化辅助腺苷二磷酸化后合成腺苷三磷酸的酶,由于家中有事,女助手只好匆忙地终止了实验,并将盛装混合液的烧杯放进了冰箱。结果第二天,女助手发现混合液已经凝固了,沮丧的她正准备重新调配混合液(像极了沮丧的我们)。
恰好此时,奥乔亚走进了实验室,看到杯中的凝固液,他没有置之不理,在简单询问女助手具体情况后,他兴奋的意识到自己可能发现了能合成核糖核酸的酶。在这之后,奥乔亚开始集中全力寻找这种可以酶。
到1956年,他终于成功分离出了这种酶,并用分离出的酶在试管中合成了核糖核酸。

赛韦罗·奥乔亚
紧随奥乔亚的步伐,1956年,亚瑟·科恩伯格(Arthur Kornberg)(又一位大佬)在大肠杆菌提取物中发现某种酶能够催化脱氧核糖核苷酸发生聚合反应,经过分离纯化,科恩伯格最终实现了短链DNA分子的体外合成。

亚瑟·科恩伯格
最后,两人因发现核糖核酸和脱氧核糖核酸的生物合成机制共同分享了1959年的诺贝尔生理学或医学奖。
刚读完这篇初稿后,你和作者可能会有一样的想法:“有这种细致的观察和认真的态度,活该人家能拿诺奖”。
然而,在仔细阅读后,作者感觉似乎有哪些地方不对劲,女助手发现试剂凝固,怎么就突然跨到奥乔亚发现核酸酶了?还有,事情真就这么巧,这么戏剧化吗?
其实这篇文章的素材,包括这戏剧化的一幕的描述,均来源于中文互联网的一篇文章。考虑到一些营销号一贯的喜欢瞎编乱造的特性,作者决定去核实一下这段历史的真实性。
结果,显而易见,在仔细查阅了众多外文网站后,在对奥乔亚生平的介绍中均没有找到对这段经历的描述。

没有找到不代表事情没有发生,那么,要如何证明或者证伪呢?转念一想,前面故事的主角一直都是奥乔亚,毕竟得诺奖的是他,但这名“女助手”真就像前面说的那样,看到试剂凝固了就想都没想,直接单纯地打算倒掉重新配吗?
从这个角度入手,作者很快就找到了这名“女助手”的身份——Marianne Grunberg-Manago,一名在苏联出生的法国籍科学家,为了方便,后文中我们称呼她为玛丽安。再然后,作者终于找到了这段历史的真实版本。

玛丽安-格伦伯格-马纳戈
接下来,就让我们从玛丽安的视角入手,回顾一下这段历史吧。(故事素材参考自奥乔亚的自传、玛丽安对奥乔亚生平的回忆文章以及L Iu Frolova对玛丽安生平的回忆文章,相关文献链接放在文末)
1953年9月,32岁的玛丽安来到了奥乔亚位于纽约大学医学院的实验室,初来这里的玛丽安感到非常不适应,因为每次在进入实验室时都必须路过一个解剖室,医学院的学生会在这里解剖尸体。
不过好在实验室的同事都很热情,大家各司其职,实验室也运转的井井有序,玛丽安很快就适应了这里的工作。

纽约大学医学院
在玛丽安到来之前,实验室的各位同事们对于午餐都感觉很无所谓,经常是在一个屋子里吃三明治了事。然而,刚到这里的玛丽安和同她一起来的博士后罗斯都觉得这样的午餐实在是太无聊了,所以它们常常一同去自助餐厅吃午饭。
过了几天,奥乔亚觉得疑惑,就问玛丽安:“为什么午饭的时候总是见不到你们呢”。在听了两位博后的回答后,奥乔亚欣然加入了去自助餐厅的行列。结果没过多久,实验室的各位同事也都放弃了无聊的“三明治式午餐”纷纷加入了玛丽安它们的队伍。
讲这段经历其实也是想说明,轻松愉悦的实验室环境对做科研也是非常有必要的,正如玛丽安在后来的回忆中提到得:“气氛完全改变了,这样非正式、轻松、无压力的午餐使实验室同事们可以就实验室内外的各种事情进行交流,讨论的话题都很有趣,大家可以互相问问题,发现技巧,在一起吃午餐的过程中,她很钦佩奥乔亚在午餐中创造的高度科学和轻松的氛围。”
回归到我们的话题,其实当玛丽安和罗斯来到奥乔亚实验室之前,作为一名酶学家,奥乔亚的主要研究方向是各种生物磷酸酶的鉴定与纯化。
当时的实验室已经配备了用来检测同位素的实验设备,通过研究带有放射性同位素32P的磷酸根在ADP与ATP之间的交换,实验室在磷酸酶相关反应方面已经很有建树。而氧化磷酸化,作为细胞内能量来源的最关键反应,在当时引起了包括奥乔亚在内的诸多团队的竞相研究。
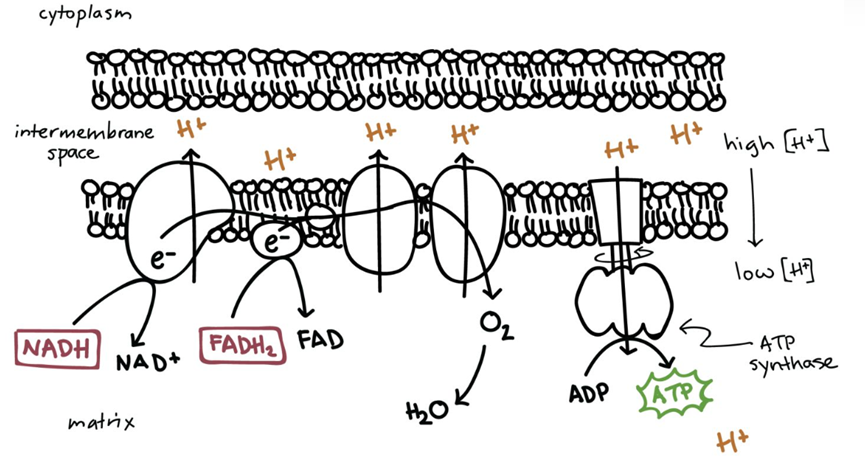
氧化磷酸化过程
在推出自己的黄金课题(即氧化磷酸化机制)之前,奥乔亚首先向两位博后提出了考验:他要求两人研究乙酰激酶催化醋酸盐(acetate)磷酸化的机制。最终,经过一段时间的研究,两人顺利的完成了奥乔亚的任务,得出了下面的式子:
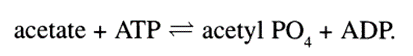
不用担心,在这里我们不需要细致地了解两人研究的具体过程,只需要知道,在参与这项研究的过程中,玛丽安在酶的纯化和性质相关研究等方面都积累了宝贵的经验。
就这样,两人都顺利的通过了这段试用期。在圣诞节前后,奥乔亚正式向两人提出“他最喜欢的课题”——氧化磷酸化。
后来,为了进行研究,玛丽安和罗斯各自选择了不同的实验对象(这一选择在后来也直接导致了两人研究结果的差异,在这里再卖个关子):罗斯选择了大鼠作为研究对象,而玛丽安因为不想杀老鼠,选择拿细菌作为研究对象。
在细菌选择方面,玛丽安进行了一定地思考:要研究氧化磷酸化,必须要找一种好氧的细菌,这种细菌应该能够主动地氧化碳水化合物,这样,找到ATP合成相关系统的概率应该会大上不少。最终,她的视线锁定在了一种固氮菌Azotobacter vinelandi(中文名为棕色固氮菌)上。
在玛丽安最初的设想中,在细菌提取物中可能存在一些可溶性的辅酶X,X在ATP合成过程中可以作为磷酸基团交换的媒介,具体反应差不多是下面这样:

读到这里,相信少部分细心的读者已经发现了,这个式子和上面玛丽安研究得到的乙酰激酶催化的反应式很相近。事实上,玛丽安也确实是从之前研究中类比得到的思路。
总之,在向纯化的ATP样品中加入细菌提取物(包含各种可溶性蛋白质)之后,玛丽安确实观察到了这种磷酸基团的交换(用的技术就是上面提到过的同位素32P检测技术)。
就在这时,当时的Sigma公司正好推出了一款代表性产品——高纯度的ATP晶体。为了验证一下自己的实验结果,玛丽安就想办法弄了一点这种产品。结果,令她诧异的是,上面的实验结果重复不出来了。

Sigma同aldrich公司合并后的logo
但是这一结果并没有让玛丽安沮丧,相反,在和奥乔亚讨论之后,两人都认为,先前的ATP试剂中一定存在某种杂质发生了实际的PO4交换反应。很快,鉴定结果出来了,先前的ATP中存在的这种神奇的“杂质”是ADP。
玛丽安仍记得,自己当时在午餐会上提出这一实验结论时,实验室里的各位都一致的表示不相信这一实验结果(因为在这之前没有关于ADP的类似反应被报道)。甚至奥乔亚自己也明确地说出“impossible”,这在一定程度上打击了玛丽安的研究热情。

然而,没过多久,当玛丽安当着奥乔亚的面重复了相关实验后,奥乔亚终于相信,玛丽安的实验中发生的真的是一种从未被发现的酶促反应过程,两人对此非常兴奋。
进一步研究中,玛丽安也发现,这种酶促反应的底物并不只是ADP,其对其它的二磷酸核苷酸(UDP、CDP、GDP和IDP)也具有类似的催化活性。
现在,唯一的工作就是从这种细菌的提取物中纯化得到这种酶,鼓足干劲的玛丽安立马开始了这种酶的寻找之旅。
然而,事与愿违的是,在最初令人兴奋的实验结果之后,连着几个月,玛丽安都没有得到令人满意的纯化结果。巧的是当时另一位同事G. Pinchot从一种微生物Alcaligenes faecalis(粪产碱杆菌)的提取物中观察到一系列与电子传递耦合的PO4吸收反应。
这一结果让奥乔亚开始觉得玛丽安的研究发现似乎也不是那么罕见,这种酶促PO4交换反应是不是压根就没什么意义?
在这里再次借用Uri Alon画的一张图:研究过程中可能产生许多不同的结果(C1-C6),但这其中只有少部分(C6)是真正值得关注的(或者说有意义的)。
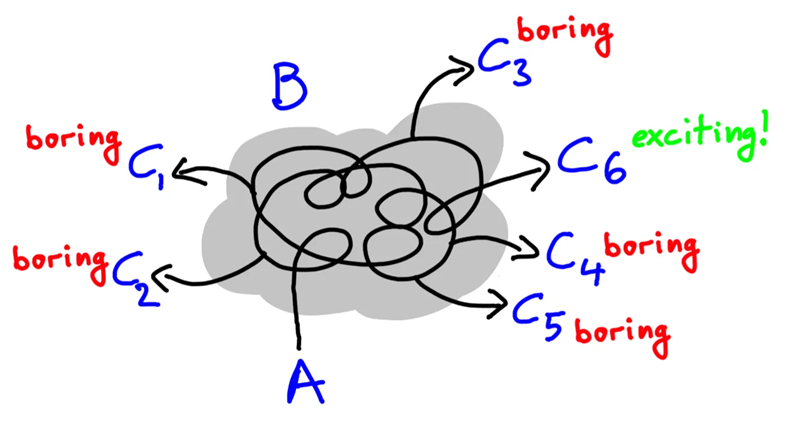
当时,奥乔亚甚至都开始建议玛丽安更换课题,用她所研究的固氮菌去重复一下Pinchot的实验结果了。
然而,就算所有人都不相信,玛丽安也没有立马放弃自己的研究项目,当时正值奥乔亚要去欧洲出差,玛丽安向奥乔亚立下军令状,如果自己在他回来之前还没能做出满意的结果,就更换课题改去验证Pinchot的实验。
结果,或许是冥冥之中自有天意,玛丽安偶然想到,自己这几个月的提取过程中似乎发现酶促反应时有轻微的PO4释放,玛丽安顺理成章的想,这种酶应该是把ADP催化成AMP了吧。
本着严谨的态度,玛丽安试图检测一下产物中是否存在AMP。然而,色谱柱分析结果显示,产物中根本没有AMP的存在。那这种神秘的产物到底是什么呢?
通过使用纸层析法,玛丽安发现,在紫外照射下,酶促反应后的混合物中确实存在一种新组份,而这种新组份并没有从色谱图的原点发生移动。这表明,一定是有某种大分子物质产生了。
看到这一结果,玛丽安感到异常兴奋,兴奋到简直想把结果立马展示给实验室里的每个人(事实上,玛丽安做博后的那几年还很少听过“核酸”这个词,所以可以说玛丽安还是低估了这一结果的重要性),但不巧的是当时实验室里没有任何人在场。
于是,玛丽安给奥乔亚打了个电话,告诉了他实验结果。奥乔亚虽然也对这一结果感到高兴,但作为一名对氧化磷酸化近乎执着的酶学家,奥乔亚还是希望这一反应参与了氧化磷酸化中的某些过程。

赛韦罗·奥乔亚
然而,不久之后,奥乔亚才真正意识到这项研究的重要性,用他的话来说,当他在一个研讨会最后简短的提了下这个发现之后,像往常一样在研讨会上打瞌睡的H Kalckar直接从椅子上跳了起来,完全清醒了过来(H Kalckar是腺苷酸激酶的发现者之一)。
最后,玛丽安等人对反应产生的聚合物大分子进行了细致的分析,结果表明,这种聚合物的分子量很高,且具有二酯键的结构。另外,使用四种核苷二磷酸(ADP、UDP、GDP、CDP)玛丽安还合成出了一种含有四种碱基的聚合物。
1955年春天,玛丽安在旧金山的实验生物学联合会会议上展示了这项研究成果,在玛丽安的报告之前,偌大的会议厅里空无一人,到后来,随着报告内容的迅速传播,报告厅里直接挤满了人,这一发现引起了人们相当大的兴趣——这是人类第一次在体外合成了RNA样的高分子量聚合物。
值得一提的是,在酶的命名方面,最初奥乔亚觉得这种酶应该参与了体内多核苷酸的合成,因此倾向于称其为RNA合成酶,但是严谨的玛丽安却表示反对,因为这种酶在体外不仅表现出合成RNA样聚合物的性质,在某些情况下,其也能催化这一过程的逆反应。
最终,奥乔亚选择尊重玛丽安的想法,将这种酶命名为多核苷酸磷酸化酶(Polynucleotide phosphorylase, PNPase)。
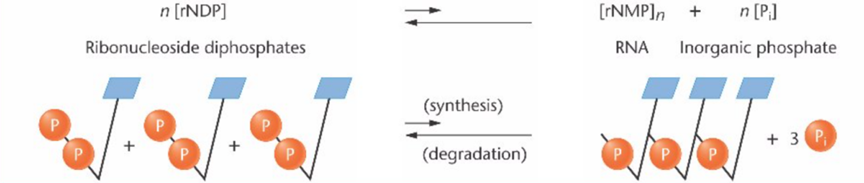
PNP酶催化的可逆磷酸化反应
后面的故事我们已经知道了,科恩伯格在玛丽安等人的工作之后紧接着分离出DNA聚合酶,奥乔亚和科恩伯格最后共同分享了1959年诺贝尔生理学或医学奖。

赛韦罗·奥乔亚获得1959年诺贝尔生理学或医学奖
然而,故事到这里还并没有结束,多年之后,科学家们证实,玛丽安发现的这种酶(PNPase)在细胞内发挥的真实功能其实是RNA的降解,而非RNA的合成。
事实证明,玛丽安的谨慎是对的。就在诺奖颁发两年后,真正意义上的RNA聚合酶由赫维茨(Jerad Hurwitz)和韦斯(Samuel B.Weiss)等人成功分离了出来。

杰拉德-赫维茨
虽然玛丽安分离到的并非真正的RNA聚合酶,但其能在不依赖DNA模板的情况下催化核糖核苷酸聚合的性质,在后来的密码子鉴定等各种科学研究的过程中也发挥了重要作用。
在刚翻阅完这段历史之后,作者首先感到的是一些找到真相的愉悦感,在最初查到的那篇近乎完全瞎编的故事背后原来是这么生动的一段历史。后来,在从玛丽安的视角去经历完这段历史之后,我开始被玛丽安身上表现出的各种精神品质所打动。
玛丽安的研究成果是天时、地利、人和齐聚的情况下产生的,如果没有奥乔亚这名伯乐的悉心栽培和全力支持,如果没有实验室轻松开放的学术交流环境,如果玛丽安开始时选的实验对象是大鼠(PNPase后来证实在哺乳动物中不存在),如果sigma在当年没有推出他们的ATP结晶产品,玛丽安可能都无法做出这一重要发现。
然而,天时不如地利,地利不如人和,玛丽安在实验结果遭到质疑时候表现出的坚持,在实验结果与预期不一致时显露出的思考,在最终对酶进行命名时体现出的严谨,这些都是值得我们去学习和不懈追求的精神品质。

玛丽安-格伦伯格-马纳戈
最后,让我们致敬这位曾为生命科学进步做出过实质贡献的科学家。
参考文献:
[1] Ochoa S. The pursuit of a hobby. Annu Rev Biochem. 1980;49:1-30.
[2] Grunberg-Manago M. Severo Ochoa, 24 September 1905-1 November 1993. Biogr Mem Fellows R Soc. 1997;43:349-365.
[3] Frolova LIu. Mol Biol (Mosk). 2013;47(3):526-527.
-----
作者/捉蝴蝶的猫
编辑/果粒珍珍


