George Church:多重基因组工程与测试(一)
发布时间:2022-11-15讲 座 主 题
关于多重基因组工程(multiplex genome engineering)以及我们如何用它来进行新应用的测试。
主 讲 人 简 介

George Church
哈佛医学院遗传学教授、美国科学院院士、美国工程院院士、富兰克林鲍尔科学成就奖得主。Church合著超过625篇论文,拥有156项专利和一本著作《Regenesis》。Church在基因组学和合成生物学领域卓有建树,他开发了首个基因组测序方法,大大降低了测序成本,为几乎所有“下一代测序”方法和和公司做出了贡献。此外,他的团队发明了用于人类干细胞和基因组编辑和其他合成生物学应用的CRISPR技术,包括创建器官移植方法、逆转衰老的基因疗法等。
讲 座 内 容
我们于2022年年初在PNAS上发表了有关分子晶体管(Molecular transistors)的工作,这使纳米孔(Nanopore)技术和荧光显微测序(Fluorescent microscopy sequencing)技术得到了发展,为下一代测序和高分辨率三维显微成像做出了贡献。开发这些不同的基因组读取新技术是实现基因组读写的一部分,只有知道从哪里开始和想做什么,你才能进行基因组编辑和基因治疗。
我们希望进一步降低医疗成本,提高交付率,做到低成本高质量。对于罕见的遗传疾病,我认为主要负担在于遗传咨询(Genetic counseling)方面。根据Larry Lynd估计,某些罕见疾病的治疗费用可能高达2000万美元(很多已经被批准的罕见药,患者终身都要接受治疗)。
对于目前的遗传咨询来说,单基因(外显子组)测序只要80美元,而全基因组测序也只要300美元,这样,无需基因编辑,就能通过分析测序数据来预防某些遗传疾病。一般来说,疾病越罕见,医疗费用就越高,这是一个很大的波动范围。
对于传染病,通过测序能够进行预先监测;而对于常见病来说,测序则能够分散研发的高昂成本。我们可以在不同的阶段利用遗传学知识,提前对隐性携带者进行筛选(大约有283个基因可被常规筛选)。例如,对于体外受精的试管婴儿,可以进行胚胎植入前检测(Preimplantation Genetic Testing, PGT),而在产前阶段,则可以进行非侵入性测试。
但是,有些情况下,胚胎也会不可避免的通过早期筛查,这时就需要对新生儿进行检测(目前的新生儿测试中有275个相关基因需要被检测)。随后,在儿童成长期,则需要持续进行诊断奥德赛 (Diagnostic Odyssey)。到了成年人阶段,根据美国医学遗传学学会指南,有73个基因被推荐用于治疗癌症、心血管等疾病,它们可以被用于指导手术种类和药物类型的选择。
Diagnostic Odyssey:诊断奥德赛,指从遗传疾病或罕见病的症状或特征出现,到患者及其家属受到最终诊断的时间,往往涉及到多次转诊和与专家会面。
基因疗法
我们知道,技术的发展已经使DNA读写的能力有了约2000万倍的提升。而在治疗方面,成本却增加了数十亿美元。美国食品药品管理局(Food and Drug Administration,FDA)已经批准了多种细胞和基因疗法,事实上,其中许多疗法都涉及到了细胞和基因的改变。
放在相似背景下,有人认为我们熟知的疫苗和基因疗法类似,但基因治疗药物Zolgensma(诺华旗下治疗脊髓性肌萎缩的AAV基因治疗药物)一剂就需要250美元,而一剂Astra-Zeneca(阿斯利康)的新冠疫苗只需要两美元。
值得注意的是,非病毒也可以作为载体,所以造成差异的主要区别其实不在于载体,而在于使用频率及受众。一款产品如果要低成本地进行大规模生产,那一定需要很多受众。
世界上排名前四(基于使用人口)的疫苗都是基因改造的实例,本质上这与基因治疗中使用到的技术并无两样:用病毒颗粒或脂质纳米颗粒(Lipid Nanoparticle, LNP)包裹单链DNA、双链DNA或mRNA,但价格却存在巨大差异(2美元到200美元)。我认为,造成这种价格差异的原因主要在于市场规模的不同,这是我们作为研究者需要去认真思考的问题。

基因组工程的方法和应用
非同源末端连接(Non-homologous End Joining)虽然不是唯一的,但却是最简单的造成基因组混乱的方法,我们有时候也将其称为基因组破坏者(genome vandalism)。
我们可以针对性地对1-2个碱基进行编辑,但编辑的过程并不能被完全地预测和控制。对这种类型来说,脱靶确实存在,虽然也不是什么大问题。
同源定向修复(Homologous Directed Repair, HDR)可以通过提供供体DNA使编辑结果相对精确,但这种方法使用起来相对困难。我们在人类细胞中进行的基于CRISPR的HDR研究,现在正在临床阶段,但相对来说,这一技术仍具有很强的挑战性。
单碱基编辑(Base Edit, BE)足够精确,但可以使用的碱基编辑类型受到限制(现在能实现A→G或C→T),且过程伴随有脱靶和其它缺陷。先导编辑(Prime Editing, PE)是结合逆转录和广义同源重组的一种编辑方法。还有基因书写(Gene Writing),使用逆转录和转座机制,可以插入相当大的片段。
editas,Beam和TESSERA是一些具有代表性的基因编辑技术孵化企业。

在当前主要的基因组编辑相关应用中,我们已经参与的包括Juno和editas牵头的早期体外CAR-T治疗项目。基因编辑细胞能够帮助克服更多更复杂的问题,这也正是器官移植急需解决的。为此,我们与联合治疗公司合作并共同创立了eGenesis。
INARI公司瞄准罕见遗传病的治疗,而GRO公司则是尝试通过创造新的氨基酸合成新化合物以制造新药。另外,我还参与了三家与逆转衰老相关的公司:REJUVENATE BIO,BioViva和MARBLE,以及濒危物种和气候变化研究公司colossal(复活猛犸象计划)。
比起小片段、随机或半随机的基因编辑技术,我们更侧重于开发多重、精确、大片段编辑技术。其中一种方法是使用重组酶(recombinases)和整合酶(integrases)。有些语境下这两个词可以混合使用,但在这里我会进行区分。
重组酶,有时称为单链退火蛋白(Single srand annealing protein, SSAP)它们与单链DNA结合蛋白(Single strand DNA binding protein, SSB)相互作用,能够显著提高编辑效率。我们在这一方向已经研究了二十多年,近期才发现这可以让SSAP克服宿主兼容性问题。另外有两种类型的整合酶,不同于重组酶,它们能使两个双链分子相互交换,却不暴露于核质中产生任何单链缺口或双链断裂(Kale,Tina和Wein正在进行相关工作)。
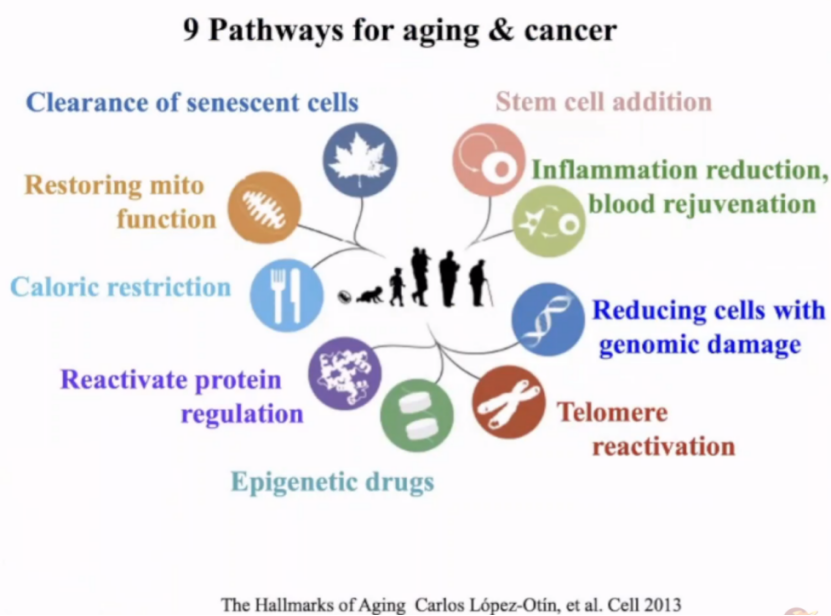
在衰老过程中,一些基因的表达会下降,而另一些则会上升。现在关于逆转衰老的方法主要有9种,包括线粒体、端粒、血液成分、衰老细胞清除等方面。而在这些途径中,我们发现很多基因的表达是下降的,因此,我们尝试逆转这些基因以将其恢复到年轻时的水平。作为基因组工程应用的一个例子,我们正在使用简单的工程工具来添加缺失基因,或尝试增加低拷贝/低表达基因的转录表达。
编 者 补 充
通过细胞治疗衰老主要分为使自身细胞不衰老和影响周围细胞不衰老两个方向。对于自身细胞不衰老,我会介绍一些相关研究,通过导入几个基因后,细胞和动物都可以做到不衰老;而影响周围细胞不衰老,则是由于细胞在死亡的时候会释放炎症因子,我们可以通过避免细胞死亡或者降低炎症因子的产生而做到抗衰老。
我们尝试测试了多种年龄相关疾病的生物标记物,发现其中有些是已知因素的变化,但也存在一些此前未知的因素的变化。我们一次采集三组基因,把已知部分作为起点,在每一种遗传途径中选取了代表性的基因,9种途径中共有50个具有代表性的基因,使用类似AAV基因疗法的方法分别测试其功能。
比如针对癌症和细菌性疾病,我们已经开发了一种联合疗法,相关方向已发表四篇论文。Noah Davidsohn是一名博士后研究员,他参与了这四篇论文中的三篇,其中涉及到的三种病毒载体(AAV9、CMV、AAV8)如下表所示。AAV的包装尺寸非常有限,大约4.7~4.9kb。巨细胞病毒(CMV)则超过100kb(类似疱疹病毒载体)。
这里还列出了我们尝试修改的所有基因,通常每次修改1-3个。在这之中我们发现了某些具有“返老还童”作用的血液因子,以及某种干细胞因子,它能使分化细胞变回未分化的胚胎细胞,随后我们也在小鼠模型上成功进行了实验验证,发现这些细胞因子确实能够逆转早衰老鼠的某种或所有生理症状。
另外,我们通过腺病毒载体提高了三种长寿基因FGF21、sTGFβR2、αKlotho的表达,改善甚至完全逆转了衰老导致的肥胖、II型糖尿病、心力衰竭和肾衰竭等疾病。我们还把三种山中伸弥因子(Oct4、Sox2和Klf4,简称OSK)送入了小鼠体内,这促进了受损的视网膜神经节细胞轴突再生。
Noah Davidson在几年前创办了REJUVENATE BIO公司。下图中的七种疾病我们均在小鼠模型中做过试验,也成功在狗身上进行过试验。其中,心脏二尖瓣疾病(Mitral valve diseade)对于某些品种的西班牙猎犬【编者注:可卡犬和杜宾犬】来说是致命的,而REJUBENATE BIO开发的疗法则可能催生出一种用于犬类治疗的兽医产品,目前相关研究正在临床试验阶段。
图片
视频链接:
http://www.isynbio-talk.cn/#/video/video-info/172


